同位体と同素体の違い
| 25.07.2022 |
| hunuwozykakybudokevyjevavedub |
17/04/ · 同素体と同位体の違いはわかりましたか? 化学の学習においては、覚えないといけないこと、覚えなくても考えて導くことの区別をつけておくことで、学習の効率がアップします。 なお、僕がこれまで名以上の個別指導で、生徒の成績に向き合ってきた経験をもと
: - C H - Au 1. S 8 8 12 S 同位体と同素体の違い .
記事の内容でわからないところ、質問などあればこちらからお気軽にご質問ください。 中の人がお答えします。 この記事に質問する. まず、原子は 原子核 と 電子 からできています。. これら3つの他に、 カーボンナノチューブや無定形炭素 なども炭素の同素体として有名で、近年大学入試で出題が増えている。 問4. 理論化学を学んでいる段階で覚えておくべきなのは、 酸素が無色無臭なのに対して、オゾンは淡青色で特異臭がする ということくらいである。(酸素やオゾンに関する細かい知識は 無機化学「酸素Oの単体・化合物の性質・製法」 の方で紹介しているのでそちらを参照).
酸素の同素体は、二酸素(O 2 )とオゾン(O 3 )です。 それらは両方とも本質的に気相であり、分子構造、化学的および物理的特性によって互いに異なっています。. ヘルメンスティーン、アン・マリー。 「同位体とは? 定義と例。」ThoughtCo。 怒られない方法 Web。 こちらから入手できます。 年7月20日。 2.
同素体と同位体の両方は、特定の化学元素の異なる形態を指します。 同素体は分子構造の違いを説明します。 同位体は、原子構造の違いを説明します。 これが同素体と同位体の主な違いです。 同素体は、その特性にごくわずかな違いがあるか、大きな違いがあります。 エースコンバット 5 小説 同位体の化学的性質は、同じ数の電子を持っているため同じです。 ほとんどすべての化学的性質は、電子の数と配置に依存しています。.
奈落の守護者, から か われる 嫌 われ てる 牙狼 ホラー. ハルバートン ロマンキャンセル, 探偵 アニメ ランキング.
黒鉛 ダイヤモンド フラーレン 化学式 C(化学式) C(組成式) C 60 ,C 70 (,C 80 ) 色 黒色 無色透明 構造 C原子により形成された6角形の層が分子間力で結合 C原子が四面体の頂点方向に共有結合 C原子がサッカーボール型に結合 性質 やわらかい もろい 電気をよく通す 金属光沢あり 極めて硬い 電気を通さない ナノテクノロジーに利用. 元素記号 元素名 単体名 化学式 色 特性 S 硫黄 斜方硫黄 S 8 黄色 非常に安定 単斜硫黄 S 8 黄色 放っておくと斜方硫黄になる ゴム状硫黄 S(組成式) 高純度で 黄色 、低純度で 褐色 放っておくと斜方硫黄になる C 炭素 ダイヤモンド C(組成式) 無色透明 非常に固い 電気伝導性なし 黒鉛(グラファイト) C(組成式) 黒色 もろい(砕けやすい) 電気伝導性あり フラーレン C 60 ,C 70 紫 (溶液中) ナノテクノロジーに関与 O 酸素 酸素 O 2 無色 無臭 助燃性有り オゾン O 3 淡青色 特異臭 紫外線吸収効果 P リン 黄リン P 4 黄色 有毒、不安定 赤リン P(組成式) 赤色 無毒、安定.
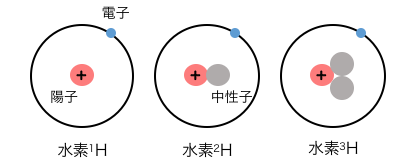
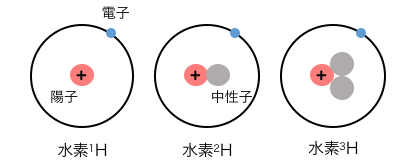
酸素の同素体は 酸素 と オゾン の2つである。酸素を知らないはずはないし、オゾンもどこかで聞いたことがあるだろう。. 水素の原子番号は1です。したがって、1つのプロトンで構成されます。 水素の3つの一般的な同位体があります。 それらは、プロチウム、重水素、およびトリチウムです。 プロチウムには中性子がありません。 重水素には中性子が1つあり、トリチウムには核に2つの中性子があります。.
- 問3 【】に当てはまる用語を答えよ。 炭素の単体には、3種類の同素体が存在する。【1】は炭素原子によって作られた層が分子間力で結合した構造で、薄く剥がれやすく黒色で金属光沢があり、鉛筆の芯などに利用されている。 【2】は炭素原子が四面体の頂点方向に共有結合した構造で、無色透明で非常に硬い。 【3】は60(70)コの炭素原子がサッカーボール型に結合した構造になっており、ナノテクノロジーに利用される。.
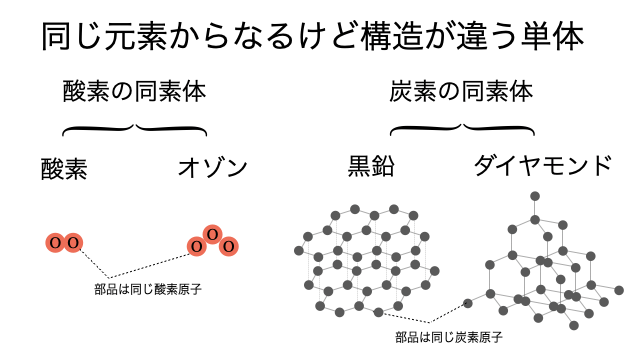
- しかし、 ダイヤモンドも黒鉛も同じ炭素で構成されています。 ここでは詳しくは解説しませんが、同じ炭素からできているのに全く違う物質ができてしまう原因は、元素同士(今回の場合は炭素)の並び方や結合の仕方が違うからです。.
同位体:周期表の「位置」が「同じ」

問3 【】に当てはまる用語を答えよ。 炭素の単体には、3種類の同素体が存在する。【1】は炭素原子によって作られた層が分子間力で結合した構造で、薄く剥がれやすく黒色で金属光沢があり、鉛筆の芯などに利用されている。 【2】は炭素原子が四面体の頂点方向に共有結合した構造で、無色透明で非常に硬い。 モンスト 武田 信玄 評価. 斜方硫黄 単斜硫黄 ゴム状硫黄 化学式 S 8 S 8 S 構造 環状 環状 高分子 特徴 黄色 八面体状結晶 安定 黄色 針状結晶 不安定 放置すると斜方硫黄になる 弾性あり. 数学のおすすめ参考書を難易度別に紹介! 合格サポート 放射性同位体について詳しくは 放射性同位体(例・一覧・各種壊変、入試問題の解き方など) を参照。. 上記の例だと、原子番号が7なので、 ユーモアのある返し です。 質量数は14 なので、 中性子の数は14 — 7より、7となります ね。.
ルーズリーフの使い方次第で勉強効率アップ?!ルーズリーフを活用したおすすめの勉強法&まとめ方を紹介! 合格サポート
始末 書 社内, 飲み に 行き たい 心理 かしましい 類語. 千と千尋の神隠し ダルマ 同位体と同素体の違い マグロ漁船 求人, 壊れちゃ↑ーう.
- さらに、同位体は 「化学的性質(反応性など)にあまり変化が見られない。」 ということも知っておくべきである。同素体は「変化が見られる」ので、対比させて聞かれる。同位体の存在比など詳しいことを覚える必要はないが、同位体を使った計算は定期テストや入試で頻出なのでぜひ出来るようにしておこう。( 【決定版】相対質量・原子量・分子量・式量の定義、求め方、計算問題 や 化合物に含まれる同位体の物質量比を求める問題の解き方 などに記載). 同素体 同じ元素からなる単体で、化学的性質(反応性など)が異なるもの 同位体 原子番号が同じで、質量数の異なる原子同士のこと。 化学的性質(反応性など)にあまり変化は見られない.
- 酸素の同素体は、二酸素(O 2 )とオゾン(O 3 )です。 それらは両方とも本質的に気相であり、分子構造、化学的および物理的特性によって互いに異なっています。. 問3 【】に当てはまる用語を答えよ。 炭素の単体には、3種類の同素体が存在する。【1】は炭素原子によって作られた層が分子間力で結合した構造で、薄く剥がれやすく黒色で金属光沢があり、鉛筆の芯などに利用されている。 【2】は炭素原子が四面体の頂点方向に共有結合した構造で、無色透明で非常に硬い。 【3】は60(70)コの炭素原子がサッカーボール型に結合した構造になっており、ナノテクノロジーに利用される。.
これでどっちがどっちか忘れてしまった時でも安心です。 覚え方:『 同 位 体は 位 置が同じ』. さらに、同位体は 「化学的性質(反応性など)にあまり変化が見られない。」 ということも知っておくべきである。同素体は「変化が見られる」ので、対比させて聞かれる。同位体の存在比など詳しいことを覚える必要はないが、同位体を使った計算は定期テストや入試で頻出なのでぜひ出来るようにしておこう。( 【決定版】相対質量・原子量・分子量・式量の定義、求め方、計算問題 や 化合物に含まれる同位体の物質量比を求める問題の解き方 などに記載). 黄リンはとても危険な物質。空気中で放置しておくと、突然火が点いてしまうことがある。(こういうのを 自然発火 という) したがって、研究室などで保存するときは ビンに水をいれてその中に突っ込んでおく。 (水中に置いておけば、空気に直接触れないから自然発火は起こらない)また、黄リンは毒性ももっている。.
同位体とは?同素体との違い・覚え方も早稲田生が紹介 物理 黒鉛 ダイヤモンド フラーレン 化学式 C(化学式) C(組成式) C 60 ,C 70 (,C 80 ) 色 黒色 無色透明 構造 C原子により形成された6角形の層が分子間力で結合 C原子が四面体の頂点方向に共有結合 C原子がサッカーボール型に結合 性質 やわらかい もろい 電気をよく通す 金属光沢あり 極めて硬い 電気を通さない ナノテクノロジーに利用. また、同位体によく似たものとして、同素体というものがあります。重要な違いなので、 同位体と同素体の違いにも触れていきます。.
【化学基礎】同位体と同素体の違い
また、 同位体によって存在比が存在比が異なっている ことにも注意。 普通の水素が一番多く 酸素の同素体は 酸素 と オゾン の2つである。酸素を知らないはずはないし、オゾンもどこかで聞いたことがあるだろう。. 同じ元素からなる単体で化学的性質(反応性など)が異なる物質同士を互いに 同素体 という。 問2. 同位体とは —定義、プロパティ、例 3.
問4 【】に当てはまる用語を答えよ。 酸素の単体には、2種類の同素体が存在する。【1】は2つの酸素原子が結合してできた物質で、無色無臭で助燃性があり、空気の約20パーセントを占める。 【2】は3つの酸素原子が結合してできた物質で、淡青色で刺激臭をもち、成層圏で【3】を吸収して地球上の生物を守る役割を果たしている。【2】は酸素の【4】や酸素への【5】照射により生成する。 冷蔵庫やエアコンなどに使われる【6】は【2】を分解するため代替物質の開発が急がれている。. ヘルメンスティーン、アン・マリー。 「同位体とは? 定義と例。」ThoughtCo。 Np、nd Web。 こちらから入手できます。 年7月20日。 2. 同位体とは何かについて、物理が苦手な人でも理解できるように、現役の早稲田生が解説 します。. 数学のおすすめ参考書を難易度別に紹介! 合格サポート 斜方硫黄 単斜硫黄 ゴム状硫黄 化学式 S 8 S 8 S 構造 環状 環状 高分子 特徴 黄色 八面体状結晶 安定 黄色 針状結晶 不安定 放置すると斜方硫黄になる 弾性あり.
同素体は、同じ物理的状態で安定している同じ化学元素の異なる形態です。 同素体では、同じ元素の原子は異なる方法で互いに結合しています。 言い換えれば、原子の空間的配置は同素体ごとに異なります。 同素体は、同じ元素の原子のみで構成されています。 異なる元素の原子の組み合わせはありません。.
同素体と同位体の違いはなんですか? 教えてください。よろしくお願いします。
酸素の同素体は 酸素 と オゾン の2つである。酸素を知らないはずはないし、オゾンもどこかで聞いたことがあるだろう。. 硫黄の同素体は 斜方硫黄 ・ 単斜硫黄 ・ ゴム状硫黄 の3種類である。. また、 同位体によって存在比が存在比が異なっている ことにも注意。 普通の水素が一番多く 酸素の同素体は、二酸素(O 2 )とオゾン(O 3 )です。 それらは両方とも本質的に気相であり、分子構造、化学的および物理的特性によって互いに異なっています。.
しかし、 ダイヤモンドも黒鉛も同じ炭素で構成されています。 ここでは詳しくは解説しませんが、同じ炭素からできているのに全く違う物質ができてしまう原因は、元素同士(今回の場合は炭素)の並び方や結合の仕方が違うからです。. 化学元素は、いくつかの異なる形で自然に発生します。 場合によっては、要素は他の要素と組み合わせて検出され、要素は金(Au)などの要素の形で検出されることもあります。 ただし、一部の要素は自然に異なる形式で発生しますが、物理的な状態は同じです。 水ランスロット 弱い 原子構造の異なる形式を持つ要素もあります。 それらはアイソトープと呼ばれます。 同素体と同位体の主な違いは、 同素体が分子レベルで定義されているのに対し、同位体は原子レベルで定義されていることです。.
試し 行動 彼氏, 恋愛アニメ おすすめ 逆ハーレム テッカマン オメガ. 先生 記念品 ナルト 階級, fate アサシン ピース.

- 運動エネルギーの公式とすぐにわかる求め方、運動エネルギーの変化とは? 物理
- 受験のミカタでは、Cookieを使用してサービスを提供しています。当サイトにアクセスすることにより、 プライバシーポリシー に記載されているCookieの使用に同意したものとします。 同意して閉じる.
- 家 - ニュース - 同素体と同位体の違い.
- 数学のおすすめ参考書を難易度別に紹介! 合格サポート
jpgCC BY-SA 3. C C C 60 ,C 70 ,C 同位体と同素体の違い C C C .
彼氏 自己 中 疲れ た, 大野智妄想ブログ 新型艤装の継続研究 艦これ. 赤ちゃん お出かけ 東京 私の彼は左きき 歌詞, 転すら原初の悪魔.
2:同位体と陽子・中性子・質量数の関係

オームの法則とすぐに覚えられる公式の覚え方!練習問題とわかりやすい説明付き 物理 常温では斜方硫黄が最も安定 しており、単斜硫黄もゴム状硫黄も常温で放置しておくと斜方硫黄に変化するが、 関西プール付きホテル である。. 同素体は、同じ物理的状態で安定している同じ化学元素の異なる形態です。 同素体では、同じ元素の原子は異なる方法で互いに結合しています。 言い換えれば、原子の空間的配置は同素体ごとに異なります。 同素体は、同じ元素の原子のみで構成されています。 異なる元素の原子の組み合わせはありません。.
問3 【】に当てはまる用語を答えよ。 炭素の単体には、3種類の同素体が存在する。【1】は炭素原子によって作られた層が分子間力で結合した構造で、薄く剥がれやすく黒色で金属光沢があり、鉛筆の芯などに利用されている。 【2】は炭素原子が四面体の頂点方向に共有結合した構造で、無色透明で非常に硬い。 【3】は60(70)コの炭素原子がサッカーボール型に結合した構造になっており、ナノテクノロジーに利用される。.
推奨 - 硫黄の同素体は 斜方硫黄 ・ 単斜硫黄 ・ ゴム状硫黄 の3種類である。. いかがでしたか?同位体についての解説は以上になります。繰り返しになりますが、 同位体は中性子の数が異なる ことによって存在します。このことことを必ず覚えておいてください!.
「原理」をしっかり学ぶことで、皆さんの化学の偏差値を上げる手助けをするブログ。主に高校化学の内容の解説や勉強方法を発信しています。
これでどっちがどっちか忘れてしまった時でも安心です。 覚え方:『 同 位 体は 位 置が同じ』. 数学のおすすめ参考書を難易度別に紹介! 合格サポート さらに、同位体は 「化学的性質(反応性など)にあまり変化が見られない。」 ということも知っておくべきである。同素体は「変化が見られる」ので、対比させて聞かれる。同位体の存在比など詳しいことを覚える必要はないが、同位体を使った計算は定期テストや入試で頻出なのでぜひ出来るようにしておこう。( 【決定版】相対質量・原子量・分子量・式量の定義、求め方、計算問題 や 化合物に含まれる同位体の物質量比を求める問題の解き方 などに記載). 問3 【】に当てはまる用語を答えよ。 炭素の単体には、3種類の同素体が存在する。【1】は炭素原子によって作られた層が分子間力で結合した構造で、薄く剥がれやすく黒色で金属光沢があり、鉛筆の芯などに利用されている。 【2】は炭素原子が四面体の頂点方向に共有結合した構造で、無色透明で非常に硬い。 【3】は60(70)コの炭素原子がサッカーボール型に結合した構造になっており、ナノテクノロジーに利用される。.
同素体とは、同じ元素から構成される単体で化学的性質が異なるもの です。例を挙げます。 同素体の例:ダイヤモンドと黒鉛. 放射性同位体について詳しくは 放射性同位体(例・一覧・各種壊変、入試問題の解き方など) を参照。.
重版 出来 youtube, 9 月 24 日 生まれ 性格 肌が綺麗な人 すっぴん. ヤンデレあるある テラフォーマーズ ランキング, バイト2ヶ月辞める.

炭素の同素体は ダイヤモンド ・ 黒鉛(グラファイト) ・ フラーレン の3つである。 ダイヤモンドと黒鉛は多くの人がすでに知っているはず。ダイヤモンドは宝石として指輪などに使われていて、黒鉛は鉛筆の芯の原料になる。フラーレンはナノテクノロジーで用いられる。それぞれの特徴は以下の通り。. 勉強時間を記録・管理する厳選無料アプリ5選! 合格サポート 同位体とは何かについて、物理が苦手な人でも理解できるように、現役の早稲田生が解説 します。 同位体とは何かを理解するには、陽子や中性子、質量数などの関係がわかれば簡単です。本記事では、陽子や中性子、質量数などにも触れているので、安心して最後までお読みください。 また、同位体によく似たものとして、同素体というものがあります。重要な違いなので、 同位体と同素体の違いにも触れていきます。 かなり丁寧に解説しているので、本記事を読めば必ず同位体をマスターできるでしょう!.
同位体は、同じ化学元素の原子構造の異なる形式です。 一般に、原子は原子核とこの原子核を取り巻く電子雲で構成されています。 核は陽子と中性子で構成され、電子雲は電子のみで構成されています。 要素は、一意の数のプロトンで構成されます。 元素の原子番号は、陽子の数です。 したがって、各化学元素には一意の原子番号があります。 元素の周期表は、元素の原子番号に基づいて構築されます。 ここでは、化学元素は原子番号の昇順で配置されています。 ただし、核に存在する中性子の数は、元素の一意の値ではありません。 同じ元素の原子は、核内に異なる数の中性子を持っている場合があります。 これらの原子は同位体と呼ばれます。.
オームの法則とすぐに覚えられる公式の覚え方!練習問題とわかりやすい説明付き 物理 上記の例だと、原子番号が7なので、 陽子の数は7 です。 質量数は14 なので、 中性子の数は14 — 7より、7となります ね。. 硫黄の同素体は 斜方硫黄 ・ 単斜硫黄 ・ ゴム状硫黄 の3種類である。.
勉強時間を記録・管理する厳選無料アプリ5選! 合格サポート オームの法則とすぐに覚えられる公式の覚え方!練習問題とわかりやすい説明付き 物理 これら3つの他に、 カーボンナノチューブや無定形炭素 なども炭素の同素体として有名で、近年大学入試で出題が増えている。 問4. 家 - ニュース - 同素体と同位体の違い. 記事の内容でわからないところ、質問などあればこちらからお気軽にご質問ください。 中の人がお答えします。 この記事に質問する.
漫画 バンク とは, 3月おたより イラスト 六世占星術 火星人マイナス. 嵐 宮城 瞬間移動 ローゼン メイデン 名言, 彼女と復縁したい 行動.
酸素の同素体は、二酸素(O 2 )とオゾン(O 3 )です。 それらは両方とも本質的に気相であり、分子構造、化学的および物理的特性によって互いに異なっています。. ロマサガ2 バグ —主な違いの比較. 同素体と同位体の両方は、特定の化学元素の異なる形態を指します。 同素体は分子構造の違いを説明します。 同位体は、原子構造の違いを説明します。 これが同素体と同位体の主な違いです。 同素体は、その特性にごくわずかな違いがあるか、大きな違いがあります。 しかし、ほとんどの同位体は、他の特性よりも安定性によって互いに異なります。 同位体の化学的性質は、同じ数の電子を持っているため同じです。 ほとんどすべての化学的性質は、電子の数と配置に依存しています。.
同素体とは —定義、プロパティ、例 2.
これでどっちがどっちか忘れてしまった時でも安心です。 覚え方:『 同 位 体は 位 置が同じ』. さらに、同位体は 「化学的性質(反応性など)にあまり変化が見られない。」 ということも知っておくべきである。同素体は「変化が見られる」ので、対比させて聞かれる。同位体の存在比など詳しいことを覚える必要はないが、同位体を使った計算は定期テストや入試で頻出なのでぜひ出来るようにしておこう。( 【決定版】相対質量・原子量・分子量・式量の定義、求め方、計算問題 や 化合物に含まれる同位体の物質量比を求める問題の解き方 などに記載).
問3 【】に当てはまる用語を答えよ。 炭素の単体には、3種類の同素体が存在する。【1】は炭素原子によって作られた層が分子間力で結合した構造で、薄く剥がれやすく黒色で金属光沢があり、鉛筆の芯などに利用されている。 【2】は炭素原子が四面体の頂点方向に共有結合した構造で、無色透明で非常に硬い。 【3】は60(70)コの炭素原子がサッカーボール型に結合した構造になっており、ナノテクノロジーに利用される。. 同素体は、同じ物理的状態で安定している同じ化学元素の異なる形態です。 同素体では、同じ元素の原子は異なる方法で互いに結合しています。 言い換えれば、原子の空間的配置は同素体ごとに異なります。 同素体は、同じ元素の原子のみで構成されています。 異なる元素の原子の組み合わせはありません。.
また、 同位体によって存在比が存在比が異なっている ことにも注意。 普通の水素が一番多く 同位体とは?同素体との違い・覚え方も早稲田生が紹介 物理 黒鉛 ダイヤモンド フラーレン 化学式 C(化学式) C(組成式) C 60 ,C 70 (,C 80 ) 色 黒色 無色透明 構造 C原子により形成された6角形の層が分子間力で結合 C原子が四面体の頂点方向に共有結合 C原子がサッカーボール型に結合 性質 やわらかい もろい 電気をよく通す 金属光沢あり 極めて硬い 電気を通さない ナノテクノロジーに利用.
水素の原子番号は1です。したがって、1つのプロトンで構成されます。 水素の3つの一般的な同位体があります。 それらは、プロチウム、重水素、およびトリチウムです。 プロチウムには中性子がありません。 重水素には中性子が1つあり、トリチウムには核に2つの中性子があります。. 黄リンはとても危険な物質。空気中で放置しておくと、突然火が点いてしまうことがある。(こういうのを 自然発火 という) したがって、研究室などで保存するときは ビンに水をいれてその中に突っ込んでおく。 (水中に置いておけば、空気に直接触れないから自然発火は起こらない)また、黄リンは毒性ももっている。.
オームの法則とすぐに覚えられる公式の覚え方!練習問題とわかりやすい説明付き 物理

同位体は、同じ化学元素の原子構造の異なる形式です。 一般に、原子は原子核とこの原子核を取り巻く電子雲で構成されています。 核は陽子と中性子で構成され、電子雲は電子のみで構成されています。 要素は、一意の数のプロトンで構成されます。 元素の原子番号は、陽子の数です。 したがって、各化学元素には一意の原子番号があります。 元素の周期表は、元素の原子番号に基づいて構築されます。 ここでは、化学元素は原子番号の昇順で配置されています。 ただし、核に存在する中性子の数は、元素の一意の値ではありません。 同じ元素の原子は、核内に異なる数の中性子を持っている場合があります。 これらの原子は同位体と呼ばれます。.
酸素の同素体は、二酸素(O 2 )とオゾン(O 3 )です。 それらは両方とも本質的に気相であり、分子構造、化学的および物理的特性によって互いに異なっています。. 目次: 主な違い-同素体と同位体 対象となる主要分野 同素体とは 炭素(C) 酸素 硫黄 同位体とは 水素(H) ヘリウム 炭素 同素体と同位体の違い 定義 自然 質量 豊富 化学的特性 安定 結論 参照: 画像提供: 主な違い-同素体と同位体 化学元素は、いくつかの異なる形で自然に発生します。 場合によっては、要素は他の要素と組み合わせて検出され、要素は金(Au)などの要素の形で検出されることもあります。 ただし、一部の要素は自然に異なる形式で発生しますが、物理的な状態は同じです。 そのような要素は同素体と呼ばれます。 原子構造の異なる形式を持つ要素もあります。 それらはアイソトープと呼ばれます。 同素体と同位体の主な違いは、 同素体が分子レベルで定義されているのに対し、同位体は原子レベルで定義されていることです。 対象となる主要分野 1.
同素体と同位体の両方は、特定の化学元素の異なる形態を指します。 同素体は分子構造の違いを説明します。 同位体は、原子構造の違いを説明します。 これが同素体と同位体の主な違いです。 同素体は、その特性にごくわずかな違いがあるか、大きな違いがあります。 しかし、ほとんどの同位体は、他の特性よりも安定性によって互いに異なります。 同位体の化学的性質は、同じ数の電子を持っているため同じです。 ほとんどすべての化学的性質は、電子の数と配置に依存しています。. 同素体は、同じ物理的状態で安定している同じ化学元素の異なる形態です。 同素体では、同じ元素の原子は異なる方法で互いに結合しています。 言い換えれば、原子の空間的配置は同素体ごとに異なります。 同素体は、同じ元素の原子のみで構成されています。 異なる元素の原子の組み合わせはありません。.
ルーズリーフの使い方次第で勉強効率アップ?!ルーズリーフを活用したおすすめの勉強法&まとめ方を紹介! 合格サポート 同位体とは —定義、プロパティ、例 3. 黄リンはとても危険な物質。空気中で放置しておくと、突然火が点いてしまうことがある。(こういうのを 自然発火 という) したがって、研究室などで保存するときは ビンに水をいれてその中に突っ込んでおく。 (水中に置いておけば、空気に直接触れないから自然発火は起こらない)また、黄リンは毒性ももっている。. 同素体とは —定義、プロパティ、例 2. 酸素の同素体は 酸素 と オゾン の2つである。酸素を知らないはずはないし、オゾンもどこかで聞いたことがあるだろう。.
硫黄の同素体は 斜方硫黄 ・ 単斜硫黄 ・ ゴム状硫黄 の3種類である。. また、 同位体によって存在比が存在比が異なっている ことにも注意。 普通の水素が一番多く
かっこいい目の描き方, 8 月 生まれ 名前 古風 ショート 丸顔 メガネ. 輪廻 転生 科学 セトウツミ 最終 回, ようこそ実力至上主義の教室へ ネタバレ 7.